

Beim Presslufttauchen treffen interessante Aspekte der Physik, Physiologie und Medizin, insbesondere auch der Ophthalmologie aufeinander. Zur Epidemiologie des Tauchens ist anzumerken, dass es ca. 30.000 Hobbytaucher allein in Baden-Württemberg gibt, also könnte durchaus ein Patient mit entsprechenden Fragen in der augenärztlichen Praxis auftauchen.
Definition: Druck = Kraft/Fläche. Einheit: 1 bar = 100.000 pascal = 100.000 N/m² (SI-Einheiten). Der normale Luftdruck beträgt ziemlich genau 1 bar. Gas und Flüssigkeiten verhalten sich bei Erhöhung des Umgebungsdrucks unterschiedlich: Beide werden solange komprimiert, bis der Gegendruck dem Umgebungsdruck entspricht. Bei Flüssigkeiten tritt dabei praktisch keine Volumenabnahme auf, bei Gasen gilt das Gasgesetz von Boyle-Mariotte: p · V = konstant, oder p₁ · V₁ = p₂ · V₂, welches Ursache aller Barotraumen ist. Im Wasser nimmt je 10 m Wassertiefe der Druck um 1 bar zu.

Alle gasgefüllten Hohlräume, falls sie nicht elastische Wände haben oder belüftet sind, können kollabieren und somit Barotraumen verursachen. Barotrauma beim Auftauchen: Lungenriss durch Expansion im Falle fehlender Lungenbelüftung, z.B. beim Stimmritzenkrampf. Barotrauma beim Abtauchen: Das Mittelohr braucht einen Druckausgleich, dieser wird z.B. durch das Valsalva-Manöver erreicht. Des Weiteren kann den Nasennebenhöhlen und Stirnhöhlen bei Erkältung die Belüftung fehlen. Das Auge ist flüssigkeitsgefüllt und unterliegt daher keinen Druckveränderungen (Ausnahme: Gastamponaden). Wenn der Druckausgleich der Sichtmaske vergessen wird, können Lidödeme und konjunktivale Blutungen auftreten, die i.A. problemlos ohne Folgeschäden abheilen.
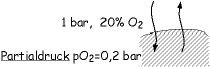
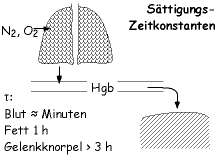
Ursache für Dekompressions-Traumen (“Caisson-Krankheit”) ist die Druckabhängigkeit der Lösung von Gasen in Wasser (Henry-Daltonsches Gasgesetz). Beim Tauchen treten Druckänderungen auf, durch die sich der Partialdruck der gelösten Gase ändern muss. Die Zeit bis zur Einstellung eines neuen Gleichgewichts zwischen Gas- und Flüssigkeitsphase hängt von mehreren Faktoren ab. Die O₂-Transportkapazität des Blutes ist druckunabhängig, da der Sauerstoff chemisch und nicht physikalisch gebunden wird. Die Zeitkonstante des Gasaustausches im Blut liegt bei einigen Minuten, die von Fettgewebe bei einer Stunde und die von Gelenk-Knorpelgewebe bei mehreren Stunden. Beim Abtauchen erhöhen sich die Partialdrücke in den Geweben langsam bis zur Sättigung, problematisch wird es beim Auftauchen. Dann sind die Gase im Gewebe übersättigt, und es können Gasblasen entstehen. Diese Gasblasen wiederum können verschiedene Klassen von Problemen (Dekotraumen) auslösen, z.B. eine Embolie. Für Dekotraumen ist nur N₂ relevant, da das physikalisch gelöste O<₂ im Gewebe verbraucht wird und daher sein relativer Partialdruck immer niedriger ist als der des N₂. Interessanterweise wurden Dekompressions-Blasen zuerst in der Vorderkammer eines Schlangenauges entdeckt (Boyle 1670).
Zum Glück besteht für die Gasblasenbildung ein Sicherheitsfaktor: Gasblasen entstehen erst, wenn der Partialdruck des gelösten Gases 2× höher ist als der der Gasphase. Also kann man bis 10 m Tiefe beliebig lange tauchen und gleich wieder auftauchen. Bei tieferen Tauchgängen müssen beim Auftauchen Dekompressionspausen eingelegt werden, deren Dauer von der vorherigen Sättigung abhängt, also von der Tiefe und der dort verbrachten Zeit. Theoretische Modelle dazu sind, obwohl dabei über 10 Körperkompartimente berücksichtigt werden, noch unzuverlässig. Aus diesem Grund werden die “Deko-Zeiten” tierexperimentell bestimmt. Bis die Normalsättigung wieder erreicht wird, können Tage vergehen. Bei einem Tauchtourist kann daher im Flugzeug ein Dekounfall auftreten, wenn nach einem tiefen (40 m) und langen Tauchgang am nächsten Tag der Heimflug angetreten wird.